정밀 약물 타켓팅과 방출을 위한 자기장 구동 및 초음파 통합시스템
박석호 교수(DGIST 로봇 및 기계전자공학과)/shpark12 at dgist.ac.kr/
2023.06.12
|
기존의 암세포에 대한 화학적인 약물 전달 치료에 있어, 치료 약물이 혈액-뇌 장벽 (Blood-Brain Barrier, BBB) 혹은 혈액-종양 장벽 (Blood-Tumor Barrier, BTB)을 통과하기 어렵기 때문에 약물의 전달효율이 매우 낮은 수준으로 암 조직뿐만 아니라 인체 정상조직에 부작용을 일으켰습니다. 이번 서면 인터뷰에서 만나 보실 박석호 교수(DGIST 로봇 및 기계전자공학과)는 생의학 마이크로나노로봇, 바이오초소형 의료 기구/인스트루먼트를 연구하고 계십니다. 동적 자기장과 약물 방출 제어를 위한 전자기 시스템 개발과 약물이 담지된 약물구조체까지 개발 중 이신데요. 연구에 대한 자세한 이야기해보도록 하겠습니다. 1. 현재 교수님께서 하고 계시는 주요 연구에 대한 간단한 소개 부탁드립니다. 저희 연구실은 크게 Electromagnetic Actuation (EMA) 시스템, Biomedical Micro/Nano Robot, Wireless Biomedical Capsule, Soft Robotics 등 다양한 주제들에 대한 연구를 진행하고 있습니다.  첫째, EMA 시스템 연구에서 강한 외부자기장을 형성시켜 다양한 생의학 로봇들을 구동시키기 위한 연구를 진행하고 있습니다. 특히, 자기적 성질이 약한 마이크로/나노 구조체를 효율적으로 구동하기 위해 강한 자기장의 형성이 중요한데, 이를 위해 다양한 형태의 EMA 시스템에 대한 연구들을 진행하고 있습니다. 둘째, Biomedical Micro/Nano Robot 연구에서 기존의 약물 주입식 암세포 치료의 부정확한 타겟팅 문제를 보완하고자 외부자기장을 통해 병변 부위로 정밀 타겟팅이 가능하여 주변 정상세포에 미치는 부작용을 최소화할 수 있는 약물전달 Micro/Nano Robot에 대한 연구를 진행하고 있습니다. 또한, Micro/Nano Robot의 타겟팅 후 외부자극에 의한 능동 약물방출을 통해 암세포 치료 효율을 높이는 것이 가능하며, 정상세포에 독성을 일으킬 수 있는 Micro/Nano Robot 내부의 자성나노입자 회수에 대한 연구도 병행하여 진행하고 있습니다. 셋째, Wireless Biomedical Capsule 연구에서 기존에 내시경을 이용한 검사 및 치료를 진행할 때, 내시경의 크기로 인해 환자가 불편함을 느낄 수 있다는 문제점을 가지고 있는데, 이를 해결하기 위해 환자가 거부감을 가지지 않고 직접 삼킬 수 있도록 수cm의 작은 캡슐 형태를 가진 능동구동 캡슐 내시경을 개발하는 연구를 진행하고 있습니다. 이러한 능동구동 캡슐 내시경은 외부자기장을 이용하여 무선으로 구동이 가능하고 소형카메라를 통한 장내 검사가 가능합니다. 추가적으로, 능동구동 캡슐 내시경에 진단 및 치료 기능의 모듈 예를 들어 장내 출혈이나 암치료를 위한 치료 패치 전달 모듈 또는 장내 미생물 다중 채취 모듈들이 개발되고 있습니다. 마지막으로, Soft Robotics 연구에서 기존의 가이드와이어를 이용한 카테터 시술의 문제를 해결하기 위해 외부 자기장 구동을 통해 복잡한 혈관을 따라서 움직일 수 있는 Soft Continuum Robot에 대한 연구를 진행하고 있습니다. 특히, 외부자기장에 의해 이동하고자 하는 경로의 형태에 맞게 형상이 변하도록 Soft Continuum Robot를 국부적으로 자화시켜 활용하는 방법에 대해 연구를 진행하고 있습니다. 2. 기존 약물전달 치료법의 문제점을 해결하기 위해 BBB/BTB Opening하는 집중초음파 (Focused Ultrasound: FU) 시스템이 무엇인지 궁금합니다. 자세한 연구방법 및 분석과정에 대한 설명 부탁드립니다. 약물전달에 있어, 뇌혈관은 BBB(Brain Blood Barrier) 라는 장벽이 존재하여 약물전달의 효율이 매우 낮다고 알려져 있습니다. 따라서 별도의 BBB Opening 과정이 없으면 혈관으로 주입된 파티클이나 약물 등이 제대로 병변부위에 전달이 안 되는 문제가 있는데, 이러한 BBB Opening을 위해 집중 초음파(FUS)와 마이크로 버블을 사용합니다. 마이크로 버블은 그 구조상 버블이 터질 때 큰 에너지가 나오는데, BBB Opening지점에서 마이크로 버블을 초음파를 이용해 터뜨리면 이때 발생하는 운동에너지를 이용하여 BBB를 여는 원리입니다. 그래서 하이드로폰을 이용하여 초음파의 강도를 측정하고, 초음파에 의해 터진 마이크로 버블을 이용하여 BBB가 얼마나 열렸는지 TEER 미터를 이용하여 관측합니다. TEER 미터는 전기생리학 분야에서 널리 사용되는 측정법으로 세포벽사이의 저항을 측정하여 세포의 밀도나 BBB opening 여부 등을 간접적으로 측정할 수 있습니다. 이러한 측정 장비로 실험을 진행하면 우리가 마이크로 버블에 초음파를 어떻게 조사해야 BBB opening이 잘되는지를 관찰할 수 있습니다. 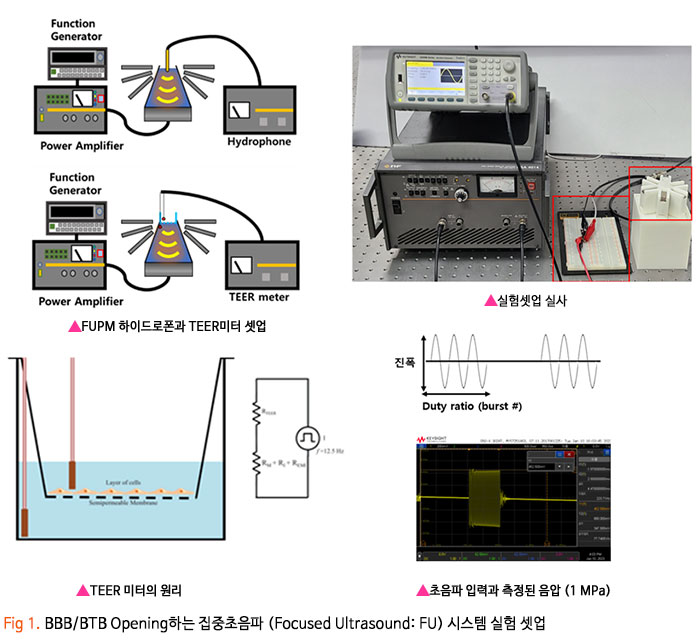 3. 강하고 정밀하게 자기 약물 전달체를 포집할 수 있는 영구자석 (Permanent Magnet: PM) 시스템과 자성 약물담지 구조체를 분산시키는 동적 자기장과 약물 방출 제어를 위한 AC 자기장을 생성할 수 있는 전자기 (Electro Magnet: EM) 시스템이 결합된 FUPEM 통합 System 개발에 대한 설명 부탁드립니다. 현재 뇌종양 치료에 용이하도록 초음파 (Focused Ultrasound, FU), 영구자석 (Permanent Magnet, PM), 전자석 (Electro Magnet, EM)이 통합된 FUPEM 시스템을 개발 중에 있으며, 이는 Brain blood barrier (BBB)내로 약물을 담지한 자성나노입자의 타겟팅을 도와주어 기존 뇌종양 시술의 한계점 (BBB 및 복잡한 조직들로 인한 낮은 약물 전달 효율, 병변 부위로의 부정확한 타겟팅 등)들을 보완하여 치료 효율을 높여줄 것으로 기대되는 시스템입니다. FUPEM 시스템을 이용한 시술 방법의 개략도는 [Fig2, 3]와 같습니다. 우선, FU 시스템과 마이크로버블을 이용하여 외부에서 유입되는 물질을 막아 뇌종양 치료 효율을 떨어뜨리는 BBB를 느슨하게 만들어줍니다. 이 때, 자체 제작 중인 자성입자가 포함된 마이크로버블을 PM을 이용하여 병변부위로 타겟팅시키고, FU 시스템을 이용하여 마이크로버블을 터뜨리면서 병변 주위의 BBB만 느슨하게 만들어줍니다. 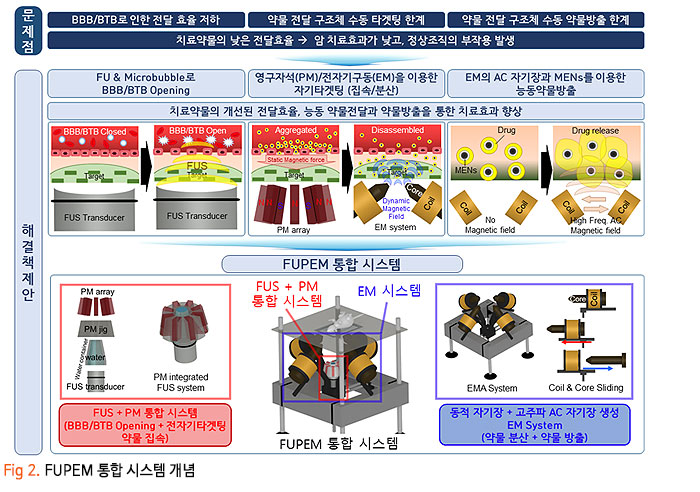 그 다음, PM을 이용하여 약물 담지 자성나노입자 (약물 전달체)를 병변 근처로 타겟팅시키고, 느슨해진 BBB를 통해 약물 전달체가 병변 부위로 침투하게 됩니다. 이 때, EM을 이용한 Dynamic field를 통해 약물 전달체가 복잡한 조직 사이를 용이하게 침투할 수 있도록 도와줄 수 있습니다. 추가적으로, EM을 이용하여 고주파의 교류자기장 형성이 가능한데, 이에 대해 능동약물 방출이 가능한 Magneto-electric Nanoparticles (MENs)를 사용하여 원하는 시기에 많은 양의 약물을 방출시켜 뇌종양 시술의 치료 성능을 높이고자 합니다 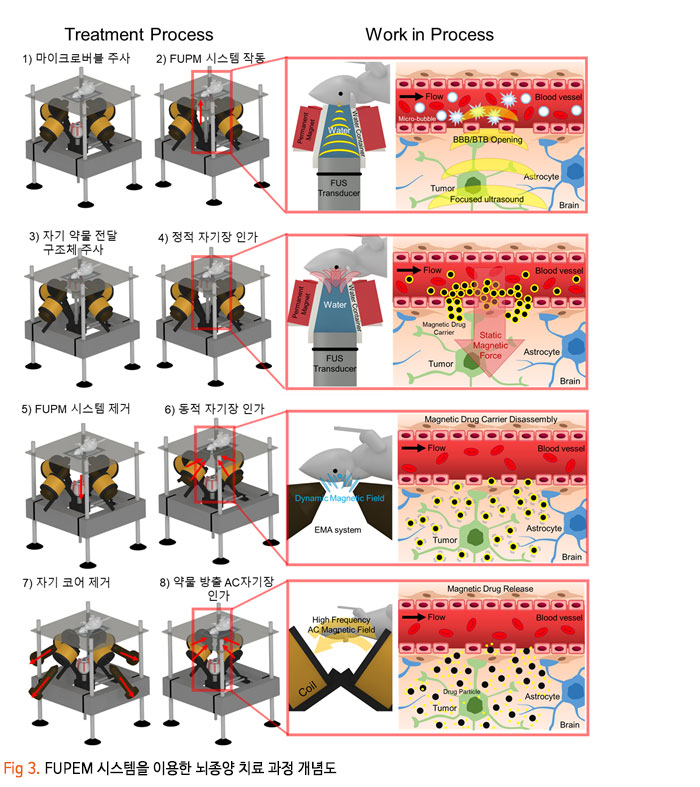 따라서 위와 같은 일련의 과정이 순차적으로 이루어질 수 있도록 FUPEM 시스템을 제작하고자 하며, 시스템 제작에 앞서 FU, PM, EM 시스템 각각의 성능을 확인한 다음 통합하는 형태로 진행하고 있습니다. 첫째, FU 시스템의 성능 확인을 위해 세포가 배양된 Transwell에 마이크로버블을 넣고 초음파를 인가할 때 세포사이의 간격이 커지면서 낮아지는 저항을 Teer Meter기로 측정하였습니다. 초음파의 세기 및 Duty ratio에 따라 측정된 저항값이 달라지는 것을 확인하였고, FU시스템이 마이크로버블을 터뜨리면서 세포의 간격을 느슨하게 하는 것이 가능함을 확인하였습니다 [Fig 4]. 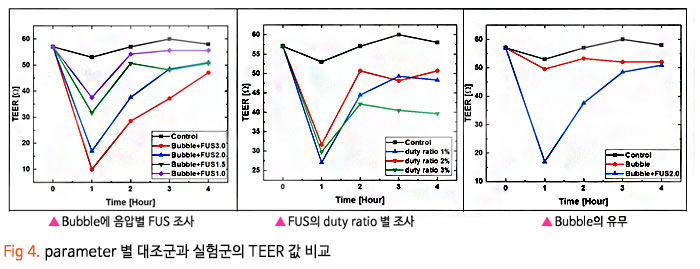 둘째, PM 시스템 성능확인을 위해 Finite Element Method (FEM) 해석을 통해 약물 담지 자성나노입자를 모을 수 있는 자석의 배치를 확인한 뒤, 직접 PM 시스템을 제작하여 실제로 시뮬레이션의 결과와 유사하게 자성나노입자의 타겟팅이 가능한지를 확인하였습니다. [Fig 5]. 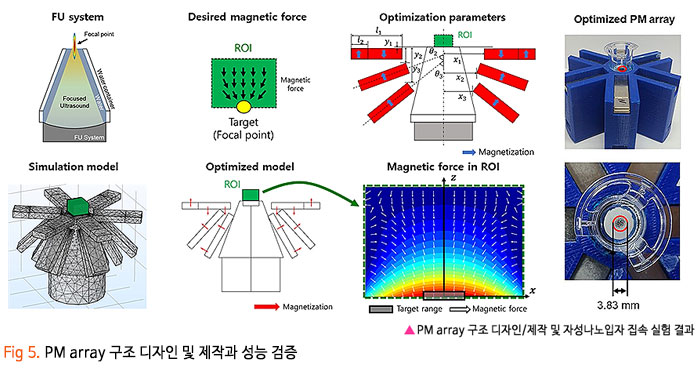 마지막으로, EM 시스템 성능확인을 위해 먼저 FEM 해석을 통해 타겟 부위에서 원하는 세기의 Dynamic 자기장이 발생할 수 있으며, 다른 시스템들과 간섭이 일어나지 않도록 코일 및 코어 형상을 설계 및 제작했습니다. 그리고 실제로 Dynamic 자기장을 인가할 때, 타겟 위치에서 자성 나노입자의 분산을 통해 Transwell membrane (0.4μm의 기공)을 통과하는데 도움을 주는지 확인 했습니다 [Fig 6]. 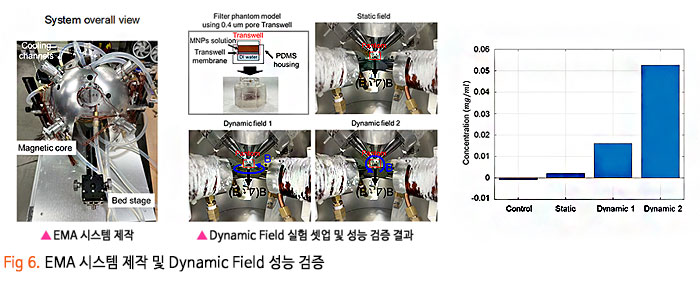 최종적으로, 위와 같은 방식들을 통해 성능이 검증된 FU, PM, EM 시스템들을 통합하여 FUPEM 시스템을 완성하여 동물 실험을 통해 의학적 검증을 진행하고자 합니다. 4. 약물 구조체로 Magneto-Electric Nanoparticles (MENs)를 기반으로 약물이 담지된 약물 구조체에 대해서도 궁금합니다. MENs는 CoFe3O4의 강자성체로 이루어진 코어와 BaTiO3의 강유전체로 이루어진 쉘을 포함하는 코어-쉘 구조의 자성나노입자입니다. 따라서 외부자기장을 인가해주게 되면 능동 자기장 구동이 가능함과 동시에 고주파수의 교류 자기장을 인가해주는 경우, 코어의 강자성체 극성이 바뀌면서 Strain이 발생하고 발생된 Strain에 의해 쉘의 강유천체가 압전효과에 의해 전기장이 발생할 수 있는 구조입니다. 약물을 담지하는 경우, Shell의 (+)전하와 약물의 (-) 전하 사이에서 정전기적 인력으로 결합되는 구조이며, 약물을 방출할 때에는 교류 자기장을 MENs에 인가해줌에 따라 코어의 극성이 바뀌게 되고, 이로 인해 쉘의 전하에 변화가 생기면서 정전기적으로 결합되어 있던 약물이 방출되게 됩니다 [Fig 7]. 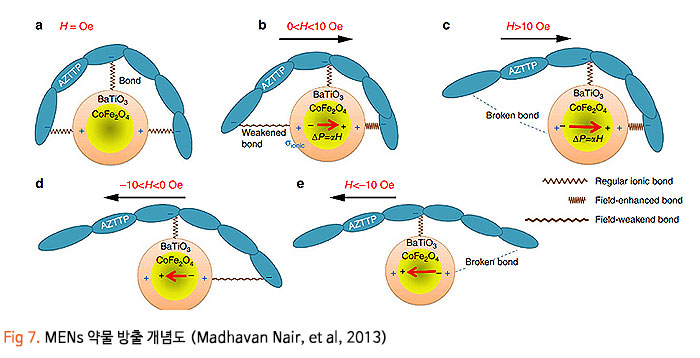 저희 연구실에서는 MENs를 설계 및 제작하고, 제작된 MENs에 대해 TEM, EDX, XRD, VSM 등과 같은 특성 분석들을 진행하고, Doxorubicin과 같은 항암제를 정전기적 인력으로 결합시킨 뒤, 흡광도 측정 및 FTIR 분석 등을 통해 약물이 담지된 것을 확인했습니다. 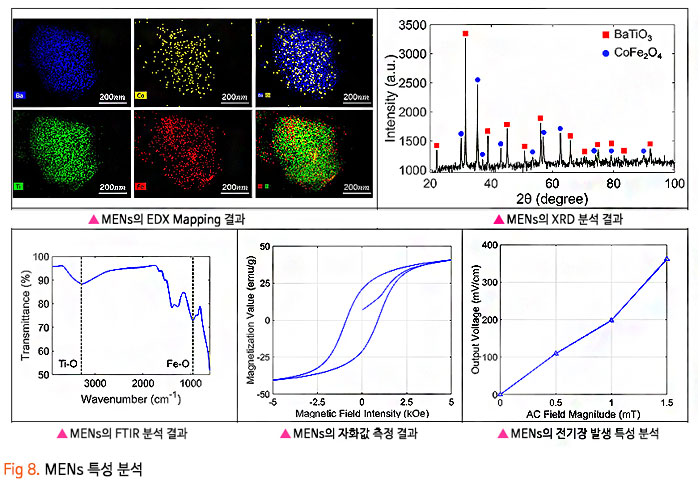 DOX가 담지된 MENs의 약물 방출 특성은 150Hz의 주파수 및 5~10Oe 세기의 교류 자기장 형성이 가능한 4개의 코일로 구성된 EMA 시스템을 이용하여 확인했으며, 방출된 약물의 양은 흡광도 측정을 통해 정량화 했습니다 [Fig 8,9]. 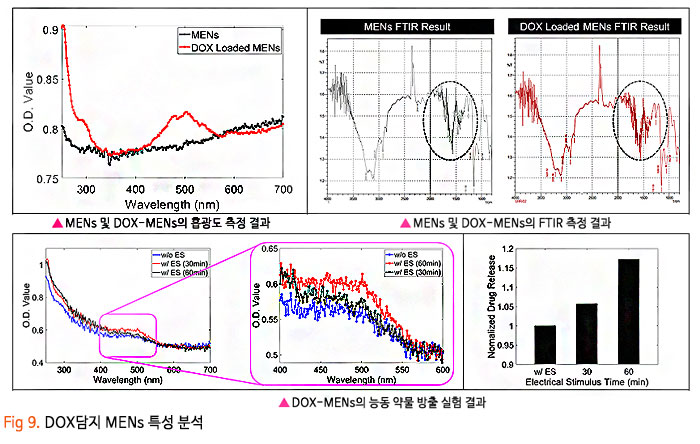 5. 마이크로 마이크로나노로봇의 구동방식으로 외부 자기장을 이용한 조향이 활발히 연구되고 있는데요. Magnetically Steerable Asymmetric Magnetized Soft Continuum Robot(AMSCR)제안 방법의 장단점과 한계점은 없나요? 최소침습 수술 등에 사용되는 수술로봇은 소형화가 매우 중요합니다. 이러한 소형화를 달성하기 위해서 외부에서 자기장으로 조향하는 Magnetically Steerable Soft Continuum Robot이 활발히 연구되고 있습니다. 보통 자기조향의 정확성이나 직관성을 위해서 로봇의 길이방향으로 자화를 시키는데, 저희는 반대로 비대칭적으로 자화를 시키고 외부자기장을 인가하여 기존 자기조향 카테터보다 훨씬 더 넓은 범위의 조향이 가능한 자기조향 카테터를 개발하였습니다. 장점으로는 기존 자기조향로봇보다 향상된 조향범위를 가진다는 것이며, 단점으로는 모델링이 복잡하다는 것과 제어 직관성이 조금 떨어진다는 점이 있습니다. 6. 마이크로 나노로봇의 생체 적합성 문제는 계속 논의되고 있는 것 같습니다. 교수님의 견해를 어떠한지 듣고 싶습니다. 마이크로 나노로봇이 의료용으로 활용됨에 있어 생체 적합성 문제는 반듯이 해결되어야 하는 부분입니다. 우선 마이크로 나노로봇을 개발함에 있어 생체 적합한 재료를 이용하여 제작하는 것을 우선으로 고려하고 있고, 그렇지 못한 경우에는 생체 적합성에 문제의 소지가 될 수 있는 부분을 사용 후 제거하거는 방법들에 대해 연구가 되어야 합니다. 또한, 의료용 마이크로 나노로봇의 개발을 위해 의료적 인증의 단계가 반드시 필요하고 이 과정을 통해 생체 적합성의 문제와 의료적 적용의 유효성과 안전성에 대한 검증 과정이 수행되어야 합니다. 추가적으로 생체 적합하면서도 생분해가 가능한 재료를 활용한다면 의료용으로 활용이 용이한 마이크로 나노로봇으로 개발될 수 있을 것으로 기대합니다. 7. 관련 연구의 국내상황과 국외상황을 구체적으로 비교해주신다면 어떤 실정인가요? 어디까지 발전되고 있는 건지 궁금합니다. 현재 국내외 연구동향을 살펴보면 대부분 의료용 마이크로 나노로봇으로 개발되고 있습니다. 모두 다양한 형태의 마이크로 나노로봇이 연구되고 있으며 대개 정밀 약물전달, 최소침습 치료 및 진단을 목적으로 하고 있습니다. 아직까지는 실제 상용화가 진행되는 사례는 매우 적은 실태이지만, 다양한 의료분야에서 그 가능성과 유효성을 보여주고 있습니다. 향후 의료기기 또는 의료용 제품으로 발전할 수 있을 것으로 기대합니다. 8. 연구 진행 중 어려운 점이 있었다면 어떤 점이었으며, 어떻게 해결해 오셨는지 알려주세요. 의료용 마이크로 나노로봇의 개발을 위해서는 다양한 공학분야의 전문가들이 협력하여 연구개발을 진행하는 것이 중요하지만, 무엇보다도 의료진의 참여가 필수적입니다. 개발의 초기단계부터 의료진이 참여하여 개발하고자 하는 마이크로 나노로봇의 필요성, 필수 기능, 개발 방향, 검증 방법 등의 연구를 함께 수행하여야 합니다. 저희가 수행하는 마이크로 나노로봇 연구에서는 신촌세브란스병원, 삼성병원, 전남대병원의 의료진이 함께 컨소시엄을 이루어 연구를 진행하고 있으며, 연구의 전반적인 과정에서 의료진의 조언 및 공동실험을 수행하고 있습니다. 9. 이런 연구에 힘입어 앞으로 연구 계획 중인 연구나 또 다른 목표가 있으신지 궁금합니다. 기존의 마이크로 나노로봇은 주로 의료용으로 개발되고 있습니다. 최근 들어 마이크로 나노로봇이 환경에 적용하는 연구들이 시작되고 있습니다. 저희 연구실에서도 마이크로 나노로봇을 이용하여 환경 문제를 해결하기 위한 연구를 시작하여 진행하고 있습니다. 예를 들어 폐수에서 특정 오염물질을 제거하거나 희귀 금속이온을 획득하는 마이크로 나노로봇을 연구하고 있습니다. 10. 앞으로 관련 분야를 공부하는 후학(대학원생들)에게 이 분야의 연구에 대한 비전을 제시해 주신다면. 현재 여러 마이크로 나노로봇이 개발되고 있으나, 아직까지는 초기단계라고 판단됩니다. 따라서, 다양한 형태와 기능을 가지고 의료 및 환경을 비롯한 여러 분야에서 응용 가능한 마이크로 나노로봇이 개발될 수 있습니다. 새로운 마이크로 나노로봇의 개발을 위해 많은 후배 연구자들의 참여와 독창적이면서 기존 기술을 능가하는 아이디어가 필요합니다. 현재 존재하는 기술로는 상상하기 어려운 이슈들을 마이크로 나노로봇 기술을 이용하여 해결할 기회를 얻을 수 있을 것이고, 이를 통해 과학기술적 측면이나 사회경제적 측면에서 파급력이 높은 연구 성과를 얻을 것으로 기대됩니다.
|
- Cell delivery microrobot
- Drug particles delivery microrobot with MNPs retrieval
- MNPs retrievable drug delivery helical microrobot
- Soft micro/millirobot
전체댓글 0























